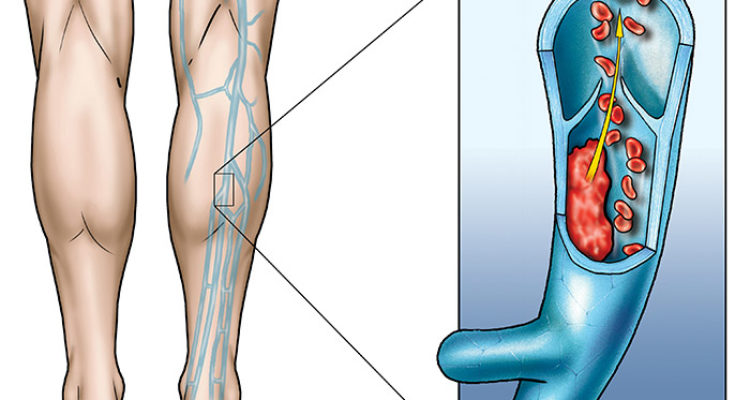
La trombosi venosa profonda (TVP) consiste nella formazione di un coagulo all’interno di una vena della circolazione venosa profonda. È una delle più comuni malattie cardiovascolari, al terzo posto dopo malattia coronarica e ictus [Cohen AT et al., 2007]. Inoltre, è una delle principali cause di morbilità e la mortalità, portando a gravi complicazioni come l’embolia polmonare (EP) e la sindrome post-trombotica (PTS) [Burgazli KM et al., 2013]. Danni locali dell’intima venosa, stasi venosa e ipercoagulabilità sono i principali fattori predisponenti e si pensa che due di questi fattori devono essere presenti per sviluppare la TVP [Bagot CN and Arya R, 2008].
Un elenco più completo dei fattori di rischio è il seguente:
Età superiore ai 40 anni; Gravidanza, puerperio; Alterazioni dei processi coagulativi; Scompenso cardiaco; Diabete mellito; Infarto miocardico pregresso; Precedente episodio di trombosi venosa; Famigliarità; Chirurgia maggiore o lesioni recenti; Terapia ormonale estrogenica; Traumatismo; Immobilizzazione prolungata; Disidratazione; Obesità; Vene varicose; Fumo
La diagnosi clinica di TVP si basa su sintomi e segni che, considerati singolarmente o nel loro insieme, non sono né sensibili, né specifici. Allo stesso modo, non è ritenuto corretto escludere una TVP basandosi sulla semplice assenza di segni/sintomi pertinenti. L’esame clinico può risultare fuorviante ai fini diagnostici, a causa della frequente paucisintomaticità della trombosi. La trombosi venosa profonda, di solito e indipendentemente dalla causa, si verifica nelle gambe. Un sintomo comune è la comparsa rapida di un gonfiore con edema che, generalmente, i pazienti notano quando si risvegliano. Il dolore al polpaccio nella dorsiflessione del piede (segno di Homan) è un test efficace, ma poco specifico perché presente solo nella metà dei pazienti con TVP. L’esame obiettivo spesso rivela edema con segno della fovea e un incremento della temperatura cutanea.
La mancanza di elementi caratteristici per un riconoscimento certo della malattia richiede che la diagnosi in via definitiva sia affidata a esami strumentali. La diagnosi strumentale non-invasiva si basa soprattutto sull’ultrasonografia con tecnica di compressione della vena sotto la sonda eco (CUS). Nel caso in cui i primi esami diano risultati dubbi occorre procedere ad ulteriori accertamenti di laboratorio (soprattutto mediante la determinazione del livello plasmatico dei D-dimeri) o tramite diagnosi strumentale invasiva (flebografia).
Per quanto riguarda la terapia, è stato dimostrato che la somministrazione immediata di anticoagulanti, soprattutto le eparine a basso peso molecolare, rappresenta il trattamento di prima linea più importante [Linee guida- protocollo regione Toscana]. Gli anticoagulanti diminuiscono il rischio di successiva EP e l’incidenza di propagazione trombi [De Martino RR et al., 2012]. I filtri cavali rappresentano una protezione aggiuntiva nei pazienti con malattia tromboembolica ma da prendere in considerazione solo in presenza di inefficacia o impossibilità della terapia anticoagulante [Ref: Linee guida-protocollo regione Toscana].
I fisioterapisti seguono la riabilitazione dei pazienti con diagnosi di TVP, e la modalità di gestione di questi pazienti è stata controversa. Per decenni, la gestione conservativa della TVP con rigorosa immobilizzazione era basata sul presupposto teorico che la deambulazione e i movimenti attivi avrebbero causato la mobilizzazione del trombo con la sua conseguente migrazione verso la circolazione polmonare, causando EP e anche morte [Anderson CM et al., 2009]. Tuttavia, questa assunzione non è mai stata testata empiricamente. Inoltre, tale approccio conservativo di prolungato riposo a letto può causare complicazioni secondarie dannose per i pazienti [Anderson CM et al., 2009].
Le principali complicanze dovute ad allettamento prolungato:
• Muscolari: ipotonia, ipotrofia, retrazioni.
• Articolari: sofferenza delle cartilagini articolari, retrazioni capsulo – legamentose.
• Scheletriche: osteoporosi, dolorabilità.
• Cutanee: piaghe da decubito.
• Psicologiche: ostilità per l’ambiente, demotivazione.
Dall’analisi dei dati in letteratura emerge che diverse review sull’argomento concordano che non vi sia alcuna prova che la deambulazione aumenti il rischio di sviluppo di EP da parte dei pazienti con TVP e in terapia anticoagulante [Pillai AR and Raval JS, 2014].
Gli studi concludono che la deambulazione precoce nei pazienti con TVP con o senza EP non causa né un aumento del rischio di progressione della TVP né nuovo EP né morte [Aissaoui N et al., 2009] e che ciò è valido indipendentemente dallo stato del trombo [Qi H et al., 2014].
Oltre alla paura della EP, un’altra motivazione principale per cui si prediligeva il riposo a letto è che dolore e gonfiore si risolvono più velocemente con l’elevazione della gamba. Tuttavia, è stato dimostrato che il tasso di risoluzione di dolore e gonfiore è significativamente più veloce quando il paziente deambula con compressione [Partsch H and Blättler W, 2000]. L’immediata compressione mediante bendaggio nella fase acuta della TVP sembra essere efficace nel ridurre edema nella prima settimana, anche se non ha alcun effetto sulla regressione del trombo entro l’anno successivo [Roumen-Klappe EM et al., 2009]. Per quanto riguarda il tempo di avvio alla deambulazione dopo la diagnosi, ci sono risultati controversi nella letteratura. In passato, alcuni Autori [Kiser TS and Stefans VA, 1997] hanno dichiarato che, per prudenza, il paziente deve rimanere immobilizzato per almeno 48-72 ore durante il trattamento con anticoagulanti. Tuttavia, il più recente studio di Juenger dichiara che il riposo rigoroso a letto non è giustificato se il paziente è in terapia con l’eparina a basso peso molecolare e se è stata eseguita la compressione [Junger M et al., 2006]. Esistono diversi tipi di calze elastiche che si differenziano in preventive, terapeutiche e antitrombo per la capacità di pressione esercitata. La compressione esterna riduce la circonferenza dell’arto e aumenta la velocità del flusso sanguigno, sia nelle vene superficiali che in quelle profonde. L’aumento di velocità sanguigna riduce la stasi venosa e il rischio di formazione di trombi. Esistono anche strumenti che permettono la compressione pneumatica intermittente, con l’applicazione di un manicotto gonfiabile che comprime ritmicamente i muscoli del polpaccio o della coscia. L’immediata compressione e l’inizio del camminare possono ridurre anche l’incidenza della sindrome post trombotica (PTS) [Lowe GD, 2010].
Le complicanze della trombosi venosa profonda comprendono, oltre all’embolia polmonare (EP), la sindrome post trombotica (SPT). La SPT si può manifestare anche a distanza di mesi o anni dall’evento trombotico acuto e presenta segni e sintomi di varia gravità, quali edema, varici secondarie, iperpigmentazione, liposclerosi, atrofia fino ad arrivare all’ulcera cutanea che rappresenta l’ultimo anello di questa catena sintomatologica. La SPT si verifica in circa un terzo dei pazienti con TVP [Kahn SR, 2009], colpendo prevalentemente i soggetti di sesso femminile e i soggetti obesi [Tick LW, 2008].
Esistono diversi tipi di calze elastiche che si differenziano in preventive, terapeutiche e antitrombo per la capacità di pressione esercitata. La compressione esterna riduce la circonferenza dell’arto e aumenta la velocità del flusso sanguigno, sia nelle vene superficiali che in quelle profonde. L’aumento di velocità sanguigna riduce la stasi venosa e il rischio di formazione di trombi. Esistono anche strumenti che permettono la compressione pneumatica intermittente, con l’applicazione di un manicotto gonfiabile che comprime ritmicamente i muscoli del polpaccio o della coscia.
Nella sindrome post-trombotica si possono individuare 4 stadi:
stadio 0: è presente ipertensione venosa e il riassorbimento venoso dell’ultrafiltrato capillare è ridotto. Il sistema linfatico però compensa, per cui non è presente edema (o stasi) e non vi sono segni e sintomi.
stadio 1: riducendosi ulteriormente il riassorbimento dell’ultrafiltrato da parte del sistema venoso, il carico linfatico supera la capacità massima del trasporto linfatico, determinando una insufficienza linfatica. Compare un edema, inizialmente ipoproteico.
stadio 2: il sistema linfatico è sovraccarico di lavoro e comincia perdere capacità funzionali. L’edema diventa sempre più proteico e persistente, compaiono modificazioni tessutali quali iperpigmentazione, ipodermite, ipodermatosclerosi.
stadio 3: si aggravano i sintomi e i segni dello stadio 2 fino alla comparsa di ulcere.
Scopo fondamentale della terapia riabilitativa è quello di favorire e di stimolare i meccanismi di ritorno venoso e linfatico al cuore, migliorando nello stesso tempo il flusso ematico microcircolatorio e quindi l’ossigenazione tissutale. Le principali tecniche riabilitative in cui può intervenire il fisioterapista consistono in mobilizzazione attiva e passiva. Nel caso in cui non fosse possibile per il paziente svolgere esercizi attivi, si procederà con la mobilizzazione
passiva di tutte le articolazioni per tutta l’ampiezza del movimento, per evitare l’insorgere di rigidità particolare. I movimenti passivi esercitano una azione favorevole sul deflusso venoso e linfatico.
L’esercizio attivo segmentario è il mezzo più efficace per aumentare l’afflusso del sangue arterioso in uno specifico distretto corporeo e per contrastare l’ipotonia muscolare. Gli esercizi attivi più comuni comprendono: 1) flesso-estensione delle dita del piede 2) flessione plantare e dorsale dell’articolazione tibio tarsica 3) flessione della gamba sulla coscia e della coscia sul bacino 4) flessione della coscia a gamba tesa.
L’obbiettivo finale sarà di recuperare la deambulazione, con le dovute valutazioni da parte del fisioterapista, perché essa avvenga correttamente. Il recupero della deambulazione è efficace sia per il trattamento della TVP che dell’SPT purché le forze muscolari del piede esercitino la loro forza propulsiva sia durante la fase di spinta prodotta dall’avampiede che in fase di arresto. In tal caso viene ad essere attivata la pompa muscolare del polpaccio. Al contrario una deambulazione ad arto rigido “robotizzata” o con carico sfiorante sarà inefficace ai fini della profilassi tromboembolica (Ref: Linee Guida-protocollo regione Toscana).
Bibliografia
- Aissaoui N, Martins E, Mouly S, Weber S, Meune C (2009) A meta-analysis of bed rest versus early ambulation in the management of pulmonary embolism, deep vein thrombosis, or both. Int J Cardiol 137: 37-41.
- Anderson CM, Overend TJ, Godwin J, Sealy C, Sunderji A (2009) Ambulation after deep vein thrombosis: a systematic review. Physiother Can 61: 133-140.
- Bagot CN, Arya R (2008) Virchow and his triad: a question of attribution. Br J Haematol 143: 180-190.
- Burgazli KM, Atmaca N, Mericliler M, Parahuleva M, Erdogan A, et al. (2013) Deep vein thrombosis and novel oral anticoagulants: a clinical review. Eur Rev Med Pharmacol Sci 17: 3123-3131.
- Cohen AT, Agnelli G, Anderson FA, Arcelus JI, Bergqvist D, et al. (2007) VTE Impact Assessment Group in Europe (VITAE). Venous thromboembolism (VTE) in Europe-The number of VTE events and associated morbidity and mortality. Thromb Haemost 98:756-764.
- De Martino RR, Wallaert JB, Rossi AP, Zbehlik AJ, Suckow B, et al. (2012) A meta-analysis of anticoagulation for calf deep venous thrombosis. J Vasc Surg 56: 228-237. Ø Pillai AR, Raval JS (2014) Does early ambulation increase the risk of pulmonary embolism in deep vein thrombosis? A review of the literature. Home Healthc Nurse 32: 336-342.
- Junger M, Diehm C, Störiko H, Hach-Wunderle V, Heidrich H, et al. (2006) Mobilization versus immobilization in the treatment of acute proximal deep venous thrombosis: a prospective, randomized, open, multicenter trial. Curr Med Res Opin 22: 593-602.
- Kahn SR (2009) How I treat postthrombotic syndrome. Blood 114: 4624-4631.
- Kiser TS, Stefans VA (1997) Pulmonary embolism in rehabilitation patients: relation to time before return to
physical therapy after diagnosis of deep vein thrombosis. Arch Phys Med Rehabil 78: 942-945. - Linee guida http://www.regione.toscana.it/documents/10180/601731/Protocollo+regionale+per+la+prevenzione+del+tromboembolismo+venoso+in+Ortopedia+e+Traumatologia.pdf/81220513-8e6a-4f80-bb62-9a839dceea2e
- Lowe GD (2010) Management of deep vein thrombosis to reduce the incidence of post-thrombotic syndrome.
Phlebology 25 Suppl 1: 9-13. - Partsch H, Blättler W (2000) Compression and walking versus bed rest in the treatment of proximal deep venous thrombosis with low molecular weight heparin. J Vasc Surg 32: 861-869.
- Qi H, Zhang F, Liu Y, Yan F, Long Y, et al. (2014) Exercise versus immobilization in the treatment of acute deep
vein thrombosis during different clot-organized stage: an animal experiment. Zhonghua Wai Ke Za Zhi 52: 529
532. - Roumen-Klappe EM, den Heijer M, van Rossum J, Wollersheim H, van der Vleuten C, et al. (2009) Multilayer
compression bandaging in the acute phase of deep-vein thrombosis has no effect on the development of the
post-thrombotic syndrome. J Thromb Thrombolysis 27: 400-405. - Tick LW, Kramer MH, Rosendaal FR, Faber WR, Doggen CJ (2008) Risk factors for post-thrombotic syndrome in patients with a first deep venous thrombosis. J Thromb Haemost 6: 2075-2081.